- Apresentação
- Equipamentos
- Agendamentos
- Rede interlaboratorial
- Publicações
- Eventos

O Laboratório Multiusuário em Saúde (LMS) da Universidade de Pernambuco (UPE) integra o Instituto de Ciências Biológicas (ICB), sendo composto por duas áreas: o Núcleo de Cirurgia Experimental e a Central Analítica. Todo o empreendimento foi resultado de esforços conjuntos do ICB, da Faculdade de Ciências Média (FCM) e do Instituto de Apoio à Universidade de Pernambuco (IAUPE) apoiados pela Financiadora de Inovação e Pesquisa (FINEP).
O LMS tem apoiado o desenvolvimento de pesquisa de ponta em genética e biologia celular e molecular aplicada, favorecendo a integração das instituições que compõem o Campus Santo Amaro (ICB, FCM, Escola Superior de Educação Física – ESEF e Faculdade de Enfermagem Nossa Senhora das Graças – FENSG) e do Campus Camaragibe (Faculdade de Odontologia de Pernambuco – FOP) através da disponibilização de infraestrutura e equipamentos multiusuários para desenvolvimento dos diversos projetos de pesquisas vinculados aos docentes destas instituições, em nível de graduação (iniciação científica) e pós-graduação (mestrado e doutorado) das áreas de ciências biológicas e da saúde.
Coordenador: Prof. Dr. Bruno de Melo Carvalho![]()
Analista: Dr. Adauto Gomes Barbosa Neto![]()
Horário de funcionamento: de seg. à sexta-feira, das 7:30 às 17:00 h.
Localização:


EQUIPAMENTOS MULTIUSUÁRIOS
PLATAFORMA DE SEQUENCIAMENTO E EXPRESSÃO GÊNICA
ABI 3500 Genetic Analyzer – FILA DE ESPERA

Sequenciador de nucleotídeos e analisador de fragmentos de DNA baseado na análise de fluorescência a partir de eletroforese capilar em matriz de oito capilares, usando laser (505 nm) de longa duração em estado sólido, sendo compatível com análise de identificação humana. Atualmente, opera com os seguintes programas: Gene Mapper, Data Collection, SeqScape e Sequencing Analysis.
Amplio 96 (Loccus)

O Amplio 96 é um equipamento versátil de PCR em tempo real em placa de 96 poços para realizar detecção, quantificação e monitoramento de fluorescência em tempo real. Desenvolvido com alta sensibilidade e ampla faixa dinâmica, equipado com 6 filtros de captação de fluorescência compatível com as químicas SYBR Green, TaqMan, Molecular Beacon, MGB, ARMS PCR, Gene expression e HRM. Dispõe de varredura mecânica rápida e precisa que garante a uniformidade de iluminação de 96 poços, elimina efeitos de borda, sem necessidade de calibração ROX.
Rotor-Gene Q MDx

O Rotor-Gene Q é um equipamento versátil de PCR em tempo real para análises qualitativas e quantitativas de ácidos nucléicos, pois permite análise multiplex com tecnologia HRM (High resolution melting). Ele é capaz de ler diversos marcadores, de forma individual ou em “multiplex”, como o SYBR Green, EVAGreen e sondas. Com ele é possível realizar identificação de patógenos, genotipagem, estudo da expressão gênica, de mutações, dentre outros.
Sistema de fotodocumentação ChemiDoc XRS+ (BioRad)
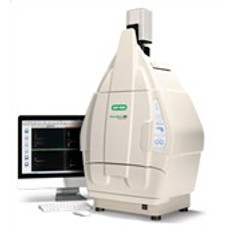
O ChemiDoc XRS+ é um potente fotodocumentador de géis e membranas, capaz de detectar e quantificar reações colorimétricas, fluorescentes e quimioluminescentes, a partir de detecção via câmera CCD acoplada à capela de detecção de imagens e operação através do software ImageLab.
PLATAFORMA DE CITOMETRIA DE FLUXO E IMUNOFENOTIPAGEM
Citômetro de Fluxo BD FASCVerse – AGENDAMENTO SUSPENSO

A citometria de fluxo é um poderoso método analítico para caracterização de células e alguns de seus produtos baseada na análise simultânea de múltiplas propriedades celulares em um sistema de fluxo contínuo . O citômetro de fluxo BD FACSVerse é equipado com dois lasers: 1) Argônio (488nm), com filtros 527/32 nm (FITC), 585/42 nm (PE), 700/54 nm (PERCP-Cy5.5) e 783/56nm (PE-Cy7); 2) Hélio-Neônio (640nm) com filtros 783/56 nm (APC-Cy7) e 660/10 nm (APC). É compatível com qualquer partícula ou célula em suspensão (células de tecidos sólidos ou culturas aderentes precisam ser desagregadas e suspensas) com tamanho entre 0,2 e 50 µm, como beads, cromossomos, bactérias, algas, fungos, células eucarióticas, protozoários, etc.
PLATAFORMA DE CULTIVO CELULAR E MICROSCOPIA
Fotomicroscópio de Epifluorescência Leica DM 2500
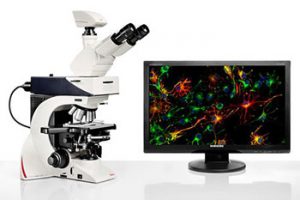
O Leica DM 2500 é um microscópio de fluorescência equipado com sistema de iluminação e conjunto ótico de alto desempenho permite determinar a distribuição de molécula simples, sua quantidade e localização dentro de uma célula, sendo especialmente adequado para as tarefas exigentes de pesquisa de ciências biológicas que requerem contraste diferencial de interferência ou fluorescência de alto desempenho. O equipamento opera com quatro (04) filtros de fluorescência: Azul (I) para DAPI; Verde (II) para FTC; Vermelho (III) para Rodamina e Texas Red; e, Violeta (IV) para CMA3. Além disso, o equipamento possui o módulo de luz branca (normal), que permite aos usuários de pesquisa clínica, por exemplo, avaliar as cores de suas amostras de forma precisa utilizando amostras de coloração HE.
Microscópio invertido Eclipse TS100 Nikon

Microscópio Invertido para rotina ou pesquisa, excelente para laboratório de cultura de celular, mas também muito usado em outras técnicas devido sua versatilidade de visualização em outros tipos de amostras em placas, garrafas, laminas e etc. O Nikon Eclipse TS100 está equipado com objetivas nos aumentos de 4x, 10x, 20x e 40x.
Incubadora de CO2 Panasonic

A incubadora de CO2 Panasonic MCO 19AIC(UV) é um equipamento moderno que permite o controle preciso e recuperação rápida dos níveis de CO2 a partir de sensores infravermelhos (IR). Seu sistema SafeCell UV fornece a segurança ideal para controle avançado de contaminação, fornecendo um conjunto ideal para desenvolvimento de pesquisas com diferentes protocolos de cultura celular.
NUCLÉO DE CIRURGIA EXPERIMENTAL – NUCEX
Rack ventilado Alesco Basic AL-20 (Alesco)

O rack ventilado Alesco Basic é um equipamento adequado para a manutenção de modelos animais em pesquisas biomédicas, confeccionados com materiais de elevada resistência e durabilidade. Esses equipamentos proporcionam um aumento na relação de bem-estar animal, garantem uma maior proteção aos animais (quando comparados às gaiolas convencionais e estantes ventiladas), impedindo a contaminação cruzada (spread) e a dispersão de alergênicos. Além disso, reduzem ruídos e odores macro e microambientais, impedindo e/ou diminuindo a relação de stress. Possuem sistemas de insuflação e exaustão que permite as trocas de ar dos mini-isoladores, retirando eficientemente os principais gases tóxicos sistêmicos (amônia e CO2), além da umidade excessiva responsável pelo crescimento de bactérias urease positiva (que transformam uréia em amônia).
CENTRAL ANALÍTICA
HPLC Agilent 1200 Series

O Cromatógrafo líquido de alta eficiência possui desgaseificador, bomba binária, injetor automático com capacidade para 100 tubos vials de 2 ml, forno e detectores de Índice de Refração (RID), de Fluorescência (FLD) e de Arrajuno de Diodos (DAD). O equipamento é bastante versátil e permite a análise de inúmeras substâncias mediante a troca da coluna cromatográfica e ajuste das condições de operação como fase móvel, vazão e temperatura. Rotineiramente o equipamento é utilizado para analisar açúcares (sacarose, glicose, frutose), surfactina, ivermectina, 6-metilmercaptopurina ribosídica (6MMPr) mas pode ser aplicado na identificação e quantificação de uma grande variedade de substâncias.
Espectrofotômetro de microplaca EPOCH BioTeK

O espectrofotômetro de microplaca Epoch™ da BioTeK é equipado com monocromador que oferece leituras de absorbância UV-Vis em qualquer comprimento de onda (200 – 999 nm), sem necessidade de filtros, em uma variedade de formatos de microplacas. O equipamento é operado a partir do Software Gen5, de interface intuitiva e de fácil programação e poderosa análise de dados a partir de processamento automatizado. Além disso, o Epoch permite a análises de varredura de espectro, ponto final, e cinéticas.
Biorreator TEC-BIO (Tecnal)

Os bioirreatores, muitas vezes chamados de fermentadores, são equipamentos onde são conduzidos processos de tranformação de meios de cultivo (nutrientes) em produtos de interesse da população com a participação de agentes biológicos sejam eles enzimas, microrganismos ou células de mamíferos. Nosso biorreator conta com vaso de 5 L, controles de temperatura, pH, agitação, aeração, alimentação de nutrientes e oxigênio dissolvido.
O Sistema de Filtração Tangencial (PAM Membranas Seletivas)

É um equipamento de bancada que permite realizar tanto micro e ultrafiltração (hollow fiber) como nanofiltração (flat) através da passagem de um fluxo tangencial, do material que se deseja fracionar, em relação a uma membrana especial. Com ele, é possível purificar proteínas, polissacarídeos, polímeros, óleos emulsionados, material particulado, vírus, bactérias, colóides e sólidos suspensos entre muitas outras moléculas graças às várias membranas de que dispomos: 100KDa, 50 KDa, 30 KDa, 10 KDa, 5 KDa e 1KDa. As membranas são barreiras feitas com alta tecnologia que permitem a passagem seletiva de substâncias de acordo com seu tamanho, formato e características.


CADASTRO DE USUÁRIOS E AGENDAMENTOS
Para solicitar agendamento de equipamento(s) do Laboratório Multiusuário em Saúde (LMS/UPE), o(a) professor(a)/pesquisador(a) deverá:
1) Ler atentamente e concordar com o regimento do LMS (Para acessar o regimento, clique aqui!).
2) Fornecer reagentes, materiais de consumo e equipamentos de proteção individual (EPIs) necessários ao manuseio adequado das amostras e do equipamento solicitado.
3) Preencher formulário de cadastramento de projeto e usuário (online):
OBS: Para acessar o formulário tradicional, clique aqui.
ATENÇÃO: Recomenda-se a solicitação de agendamento com, no mínimo, 72 h de antecedência, considerando a previsão de início das atividades.


PLATAFORMAS TECNOLÓGICAS:
Cultivo Celular e Microscopia óptica
Sequenciamento, expressão gênica e citometria
LABORATÓRIOS SEDIADOS:
Laboratório de Imunobiologia e Patologia – LIPA
Coordenadora: Profa. Dra. Patrícia Moura
Laboratório de Imunofarmacologia – LIF
Coordenadora: Profa. Dra. Sura Rocha
Laboratório de Imunometabolismo – LIME
Coordenador: Prof. Dr. Bruno Carvalho
Laboratório de Sistemas Nanoestruturados Aplicados à Saúde – LSNano
Coordenadora: Profa. Dra. Juliana S. Rebouças
LABORATÓRIOS ASSOCIADOS (com equipamento multiusuário):
Laboratório de Processos e Produtos Biotecnológicos (Núcleo de Pesquisa/ICB)
Coordenador: Prof. Dr. Irapuan Pinheiro
Laboratório de Biodiversidade e Genética de Insetos (Núcleo de Pesquisa/ICB)
Coordenadora: Profa. Dra. Rita Moura
LABORATÓRIOS PARCEIROS EXTERNOS:
Laboratório de Biotecnologia aplicada a doenças infecto-parasitárias – LABIP (Anexo IX/ICB)
Coordenadoras: Profa. Dra. Daniela de Araújo Viana Marques
Profa. Dra. Silvana de Fátima Ferreira da Silva Caires
Laboratório de Nanobioanálises Aplicadas à Saúde (Núcleo de Pesquisa/ICB)
Coordenadora: Profa. Dra. Rosana Fonseca
Laboratório de Análises, Pesquisas e Estudos em Micorrizas (Núcleo de Pesquisa/ICB)
Coordenador: Prof. Dr. Fábio Barbosa
Laboratório de Diagnóstico e Pesquisa em Biologia Molecular (Centro de Oncologia/HUOC)
Coordenadora: Profa. Dra. Tereza Cartaxo
Laboratório de Citogenética e Imunofenotipagem (Centro de Oncologia/HUOC)
Coordenadora: Profa. Dra. Tereza Cartaxo
Laboratório de Resistência Microbiana (Núcleo de Pesquisa/ICB)
Coordenadora: Profa. Dra. Márcia Morais
Laboratório de Identificação Humana por DNA (Depto. Biologia/ICB) (Desativado em Março/2019)
Coordenador: Prof. MSc. Alfredo Beuttenmüller

ARTIGOS
Barbosa Neto, A.G.; Morais, M.B.; Dutra, E.D.; Calsa Jr., T. Biological diversity of Lemna aequinoctialis Welw. isolates influences biomass production and wastewater phytoremediation. Bioresource Technology Reports, v. 6, p. 251-259, 2019.
Silva, H.R.F; Vilela, M.A.; Almeida, A.C.S.; Morais, M.M.C. Colistin-resistant KPC-2-producing Klebsiella pneumoniae ST423 harboring an IS 5-like element in the mgr B gene isolated from cerebrospinal fluid. Diagnostic Microbiology and Infectious Disease, v. 91, p. 184-185, 2018.
Mendonça, A.A.; Lucena, B.T.; Morais, M.M.C.; Morais Jr., M.A. First identification of Tn916-like element in industrial strains of Lactobacillus vini that spread the tet-M resistance gene. FEMS Microbiology Letters, v. 363, p. fnv240-5, 2016.
TESES E DISSERTAÇÕES
AMORIM, Igor Costa. Análise molecular e citogenômica de elementos de transposição no grupo Dichotomius (Luederwaldtinia) sericeus (Coleoptera: Scarabaeidae). 2018. (Doutorado em Genética) – Universidade Federal de Pernambuco, Recife, 2018.
SILVA, Crislaine Xavier da. Estudo da diversidade genética de Euchroma gigantea (Coleoptera: Buprestidae): contribuições à elucidação dos mecanismos evolutivos e status taxonômico. 2018. (Doutorado em Genética) – Universidade Federal de Pernambuco, Recife, 2018.,
SOARES, Rogean Vinicius Santos. Estudo de Euchroma gigantea (Linnaeus, 1758) (Coleoptera: Buprestidae) utilizando análise morfológica e DNA barcode. 2018. (Mestrado em Biologia Celular e Molecular Aplicada) – Universidade de Pernambuco, Recife, 2018.
COSTA, Moara Rodrigues. Caracterização e dinâmica evolutiva do satelitoma de Dichotomius schiffleri (Coleoptera: Scarabaeidae) e mapeamento cromossômico de DNAsat em espécies do grupo D. sericeus. 2018. Dissertação (Mestrado em Genética) – Universidade Federal de Pernambuco, Recife, 2018.
COSTA, Rafaelle Grazielle Coelho da. Dinâmica evolutiva de elementos transponíveis no genoma de Dichotomius schiflleri (Coleoptera: Scarabaeidae). 2016. (Mestrado em Biologia Celular e Molecular Aplicada) – Universidade de Pernambuco, Recife, 2016.
AMORIM, Igor Costa. Cromossomo B de Dichotomius sericeus (Coleoptera): Origem, comportamento meiótico e dinâmica evolutiva. 2014. (Mestrado em Biologia celular e molecular aplicada) – Universidade de Pernambuco, Recife, 2014.
MELO, Adriana de Souza. Mapeamento citogenético dos sítios de histona H3 e DNAr 5S em Rhammatocerus pratensis (Orthoptera: Acrididae) em diferentes populações do estado de Pernambuco. 2014. (Mestrado em Biologia Celular e Molecular Aplicada) – Universidade de Pernambuco, Recife, 2014.
SILVA, Crislaine Xavier da. Caracterização cromossômica de DNAs repetitivos em Dichotomius schiffleri: Contribuições ao entendimento da diversificação cariotípica em coleópteros escarabeídeos. 2013. (Mestrado em Biologia celular e molecular aplicada) – Universidade de Pernambuco, Recife, 2013.
FERREIRA NETO, Celso Alexandre. Localização de sítios de DNAr 18S em sete espécies de Dynastinae (Coleoptera: Scarabaeidae) usando bandeamento e hibridização in situ fluorescente. 2011. Dissertação (Mestrado em Biologia celular e molecular aplicada) – Universidade de Pernambuco, Recife. 2011.

WEBINÁRIOS
(Aproveita e se inscreve logo em nosso canal e ativa o sininho de notificações, clica aqui!)
JUNHO FORENSE 2021
Coordenação: Dr. Adauto Barbosa Neto (ICB/UPE)
Palestra 1

Palestra 2

CURSOS DE EXTENSÃO
BIOLOGIA MOLECULAR APLICADA A IDENTIFICAÇÃO HUMANA (Gratuito)
Coordenação: Prof. MSc. Alfredo Rodolfo Beuttenmüller de Araújo (ICB/UPE)
Objetivo: capacitar o estudante no conhecimento das metodologias empregadas, sua utilidade em face das necessidades da sociedade, na identificação de parentescos diversos, no amparo à criança por vezes desassistida, na identificação de desaparecidos e elucidação de crimes onde há vestígios biológicos.
Carga horária: 20 h (100% on line, 4 encontros ao vivo aos sábados a cada 15 dias)
Ementa: A célula; Estrutura dos ácidos nucléicos; Genes e cromossomos: estrutura e função; Divisão celular e transmissão da informação genética; Genética mendeliana: 1ª e 2ª Lei de Mendel; Mutação; Tecnologias do DNA recombinante: PCR e enzimas de restrição; Genômica: Sequenciamento de DNA e Mapa do Genoma Humano; Genética Quantitativa; Noções Básicas de Bioestatística (probabilidade, lei de Bayes); Genética de Populações; Introdução à análise forense de DNA; Análise Forense de DNA como Prova Pericial: identificação de suspeitos em casos de crimes contra a pessoa, investigação de paternidade e maternidade, verificação de vínculos genéticos, reconstrução de DNA (suposto-pai falecido, mãe ausente ou falecida).
Público-alvo: Estudantes, prioritariamente, e formados em cursos de graduação e pós-graduação nas áreas das Ciências Biológicas e da Saúde que tenham cursados e sido aprovados em pelo menos uma disciplina de Genética Básica ou Genética Médica regularmente matriculados em IES.
Cronograma:
| Atividade | Data |
| Inscrições | 26/04 a 03/05/2021 |
| Encontro 1 (Google Meet) | 08/05/2021 (8:00 às 12:00 h) |
| Encontro 2 (Google Meet) | 22/05/2021 (8:00 às 12:00 h) |
| Encontro 3 (Google Meet) | 05/06/2021 (8:00 às 12:00 h) |
| Encontro 4 (Google Meet) | 19/06/2021 (8:00 às 12:00 h) |
Inscrição: Para se inscrever é preciso ter digitalizado os seguintes documentos: comprovante de matrícula, histórico comprovando ter cursado ao menos uma disciplina de genética (básica ou médica). Para acessar o formulário de inscrição clique aqui!!!
PRESTAÇÃO DE SERVIÇOS
[Em breve]EVENTOS
[Em breve]
 Instituto de Ciências Biológicas
Instituto de Ciências Biológicas

